一份实用的循环伏安法入门指南
Noémie Elgrishi, Kelley J. Rountree, Brian D. McCarthy, Eric S. Rountree, Thomas T. Eisenhart, and Jillian L. Dempsey*®
美国北卡罗来纳大学教堂山分校化学系,教堂山,北卡罗来纳州 27599-3290
0 摘要
尽管循环伏安法日益普及,但许多学生在课程学习中并未接受过关于这项技术的正规培训。面对自学,学生们可能会感到无从下手。本文旨在简要介绍循环伏安法,以帮助读者进行数据采集和解读。文中提供了一些技巧和常见陷阱,并鼓励读者通过补充信息中提供的简短训练模块来应用所学知识。掌握了这些基础知识后,有志于成为电化学家的积极学习者会发现现有资源更易于理解,并将在理解循环伏安法方面取得更快的进步。
关键词:高年级本科生,研究生教育/研究,无机化学,分析化学,远程学习/自学,探究式/发现式学习,教科书/参考书,电化学
1 引言
1.1 动机
电子转移过程是无机配合物反应活性的核心。分子电化学已成为旨在发展可再生能源技术研究工作的中心工具。随着该领域的飞速发展,对新一代训练有素的电化学家的需求日益增长。尽管现有几本教科书和在线资源, 以及越来越多面向本科生的实验室课程, 但目前尚无一本为无机化学家编写的简明易懂的循环伏安法指南。在此,我们更新、扩充并精简了几篇开创性论文, 提供了一份单一的入门文本,反映了当前学习和使用循环伏安法的最佳实践。本文提供了以非水溶剂为中心的实践实验和示例,以帮助那些有兴趣利用电化学方法进行研究的无机化学家们快速上手循环伏安法实验。本文中的实践实验是我们实验室对新研究人员进行指导的基础。
1.2 电化学
电化学是探究涉及电子转移反应的强大工具。电化学将电子的流动与化学变化联系起来。在无机化学中,由此产生的化学变化通常是金属配合物的氧化或还原。为了理解化学还原和电化学还原之间的区别,我们以二茂铁阳离子 ,简写为,被还原为二茂铁 ,简写为为例:
- 通过化学还原剂:
- 在电极上:
为什么能够还原?最简单的解释是,一个电子从转移到,因为的最低未占分子轨道(LUMO)的能量低于中最高已占分子轨道(HOMO)上的电子能量。溶液中两个分子间的电子转移在热力学上是有利的(图1A),能级差异是反应的驱动力。
在电化学还原中,通过来自电极的非均相电子转移被还原;但这个过程的驱动力是什么呢?电极是一种电导体,通常是铂、金、汞或玻碳。通过使用外部电源(如恒电位仪),可以向电极施加电位,从而调节电极中电子的能量。当电极中电子的能量高于的LUMO时,一个电子就会从电极转移到(图1B)。这个电化学反应的驱动力同样是电极的能量与的LUMO之间的能量差。
要改变化学还原的驱动力,需要更换所用还原剂分子的种类。 电化学的核心威力在于,它能够极其简单地控制反应的驱动力,并能轻松地测量热力学和动力学参数。
[^0] 图1. (A) 到的均相还原和 (B) 非均相还原。电极中电子的能量由恒电位仪控制;它们的能量可以增加,直到电子转移变得有利。
图1. (A) 到的均相还原和 (B) 非均相还原。电极中电子的能量由恒电位仪控制;它们的能量可以增加,直到电子转移变得有利。
1.3 循环伏安法
循环伏安法(CV)是一种功能强大且广受欢迎的电化学技术,通常用于研究分子物质的还原和氧化过程。CV在研究由电子转移引发的化学反应(包括催化)方面也具有不可估量的价值。随着无机化学家们越来越多地采用电化学,文献中的论文常常包含如图2所示的图表。
 图2. 裸电极在气氛下的伏安图(蓝色曲线);裸电极在空气中的伏安图(红色曲线);(dppe = 二苯基膦乙烷)在气氛下的伏安图(绿色曲线);在空气中的伏安图(橙色曲线)。伏安图在的溶液中记录,扫描速率,使用3毫米玻碳工作电极、3毫米玻碳对电极和银丝准参比电极。
图2. 裸电极在气氛下的伏安图(蓝色曲线);裸电极在空气中的伏安图(红色曲线);(dppe = 二苯基膦乙烷)在气氛下的伏安图(绿色曲线);在空气中的伏安图(橙色曲线)。伏安图在的溶液中记录,扫描速率,使用3毫米玻碳工作电极、3毫米玻碳对电极和银丝准参比电极。
本文旨在为读者提供必要的工具,以理解图2的关键特征。下一节将提供理解这些数据的线索,解释为何要包含这些实验参数、它们的含义和影响,并更广泛地讨论如何设置实验以及在记录自己的数据时应考虑哪些参数。最后,将简要描述循环伏安法中经常遇到的响应。文中会穿插一些信息框,包含进一步信息(绿色)或潜在陷阱(红色)。还有一些额外的标注指向补充信息(SI)中提供的简短训练模块。
2 理解简单的伏安图
2.1 循环伏安图的轮廓
图2中的曲线被称为伏安图或循环伏安图。轴表示施加于系统的参数,这里是外加电位(),而轴是响应,这里是通过的电流()。电流轴有时没有标注(取而代之的是在图表中插入一个比例尺)。报告CV数据通常使用两种惯例,但很少有文献说明采集和绘制数据时所使用的符号惯例。然而,如方框1所述,电位轴为所使用的惯例提供了线索。每条曲线上都有一个箭头,指示
美国惯例
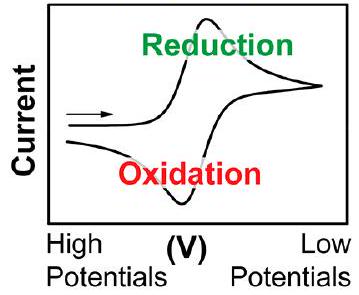
IUPAC惯例
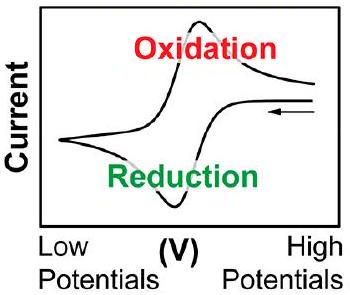
方框1. IUPAC惯例还是美国惯例?
报告CV数据通常使用两种惯例:美国惯例(本文使用)和IUPAC惯例。在视觉上,用这两种惯例报告的数据看起来像是旋转了。
记录数据时电位扫描的方向。箭头指示了第一段(或称“正向扫描”)的起始点和扫描方向,图注则说明了实验条件。图2的图注中可以找到一个关键参数:“”。这个值被称为扫描速率()。它表示在实验过程中,电位以每秒的速度(扫描速率)线性变化。
图3的图I显示了时间和外加电位之间的关系,其中电位轴作为轴,以便观察其与图H中相应伏安图的关系。在这个例子中,在正向扫描中,电位从起始电位向负方向扫描至转换电位。这被称为阴极扫描曲线。然后扫描方向反转,电位向正方向扫回,这被称为阳极扫描曲线。
2.2 理解“鸭子”形状:能斯特方程简介
为什么循环伏安图中会出现峰?考虑二茂铁阳离子()和二茂铁()之间的平衡。这个平衡由能斯特方程(方程1)描述。能斯特方程将一个电化学池的电位()与一个物种的标准电位()以及在平衡状态下系统中氧化态(Ox)和还原态(Red)分析物的相对活度联系起来。在该方程中,是法拉第常数,是普适气体常数,是电子数,是温度。
在将能斯特方程应用于到的单电子****还原时,活度被替换为它们的浓度(浓度在实验中更易于获取),标准电位被替换为形式电位,且设为1:
形式电位特定于所采用的实验条件,并且通常通过实验测定的值来估算(图3,图H中点和点之间的平均电位)。能斯特方程提供了一种强大的方法,可以预测系统如何响应溶液中物种浓度的变化或电极电位的变化。举例来说,如果将的电位施加到我们的溶液示例中,能斯特方程预测将被还原为,直到,达到平衡。或者,在CV实验中扫描电位时,电极附近溶液中物种的浓度会根据能斯特方程随时间变化。
当溶液的电位向负方向扫描时,在电极局部被还原为,导致测量到电流,并且在电极表面被消耗。由此产生的循环伏安图以及在伏安图不同点上(蓝色)和(绿色)的浓度-距离分布图如图3所示。至关重要的是,与的浓度相对于电极表面的距离,取决于所施加的电位以及物质如何在电极表面和本体溶液之间移动(见下文)。所有这些因素共同促成了“鸭子”形状的伏安图。
 图3. (A-G):在伏安图扫描过程中的不同点,(蓝色)和(绿色)的浓度分布图(mM)与距电极距离(,从电极表面到本体溶液,例如0.5 mm)的函数关系。改编自参考文献4。版权所有 © 2011, Imperial College Press。(H):溶液可逆还原为的伏安图,扫描速率为。(I):通用循环伏安实验中外加电位随时间变化的函数图,图中表示了初始、转换和结束电位(分别为、和点)。
图3. (A-G):在伏安图扫描过程中的不同点,(蓝色)和(绿色)的浓度分布图(mM)与距电极距离(,从电极表面到本体溶液,例如0.5 mm)的函数关系。改编自参考文献4。版权所有 © 2011, Imperial College Press。(H):溶液可逆还原为的伏安图,扫描速率为。(I):通用循环伏安实验中外加电位随时间变化的函数图,图中表示了初始、转换和结束电位(分别为、和点)。
当电位从点向负方向(阴极方向)扫描至点时(图3),随着被还原为,其在电极附近的浓度不断减少。在点,观察到阴极峰电流(),此时的电流由额外的通过扩散从本体溶液输送而来决定。在电极表面含有被还原的的溶液体积,被称为扩散层,在整个扫描过程中持续增长。这减慢了向电极的传质速率。因此,当扫描到更负的电位时,从本体溶液向电极表面扩散的速率变慢,导致电流随着扫描的继续而减小()。当达到转换电位()时,扫描方向反转,电位向正方向(阳极方向)扫描。虽然电极表面的浓度已经耗尽,但电极表面的浓度却增加了,这满足能斯特方程。随着外加电位变得更正,存在于电极表面的被氧化回。在点和点,电极表面的和浓度相等,遵循能斯特方程,。这对应于两个观测峰(和)之间的中点电位,并为估算可逆电子转移的提供了一种直接的方法,如上所述。由于分析物向电极的扩散和从电极的扩散,两个峰被分开了。
如果还原过程在化学上和电化学上都是可逆的,那么阳极峰和阴极峰电位之差,称为峰峰分离(),在时为(),并且正向扫描中峰的半峰宽为。 化学可逆性用于表示分析物在还原后是否稳定,并随后能被重新氧化。在还原后发生均相化学反应(如配体丢失或降解)的分析物不具有化学可逆性(见下文关于EC耦合反应的讨论)。电化学可逆性指的是电极和分析物之间的电子转移动力学。当电子转移的势垒很低时(电化学可逆性),能斯特平衡会随着外加电位的任何变化而立即建立。相比之下,当电子转移的势垒很高时(电化学不可逆性),电子转移反应迟缓,需要更负(或更正)的电位才能观察到还原(或氧化)反应,从而导致更大的。通常,电化学可逆的过程——其中电子转移速度快且过程遵循能斯特方程——被称为“能斯特”过程。
2.3 扫描速率的重要性
实验的扫描速率控制着外加电位的扫描速度。更快的扫描速率会导致扩散层尺寸减小;因此,会观察到更高的电流。 对于涉及自由扩散的氧化还原物质的电化学可逆****电子转移过程,兰德斯-赛夫切克方程(方程3)描述了峰电流 (A) 如何随扫描速率 () 的平方根线性增加,其中是氧化还原事件中转移的电子数, () 是电极表面积(通常视为几何表面积), () 是氧化态分析物的扩散系数, () 是分析物的本体浓度。
如方框2中所解释,兰德斯-赛夫切克方程可以指示分析物是否在溶液中自由扩散。由于分析物有时会吸附到电极表面,因此在分析其反应性之前,必须评估分析物是否在溶液中保持均相。除了验证分析物是否自由扩散外,兰德斯-赛夫切克方程还可用于计算扩散系数(实验模块4:二茂铁的循环伏安法:测量扩散系数)。
好的,这是您提供的文件中全部内容的完整、忠实、准确的中文翻译,并严格遵循了您要求的格式(物理化学名词加粗、行内公式用单美元符号 $包裹、行间公式用双美元符号 $$包裹、图片引用保持原样)。
3 采集数据
方框2. 自由扩散还是吸附在电极上?
对于涉及自由扩散****氧化还原物质的电化学可逆****电子转移过程,兰德斯-赛夫切克方程描述了峰电流对扫描速率的依赖性,并揭示了对的图应为线性关系。对于电极吸附的物质,电流响应由下式描述:
其中是吸附物质的表面覆盖度,单位为。
对于吸附物质,其电流响应预计与呈线性关系。
对于被认为是自由扩散的分析物,若 vs 的图偏离线性关系,则表明(a)电化学准可逆性或(b)电子转移可能通过表面吸附物质发生。检查峰峰分离有助于区分偏离的原因。对于电化学准可逆过程,峰峰分离随扫描速率变化;而对于表面吸附物质,则观察不到峰峰分离。
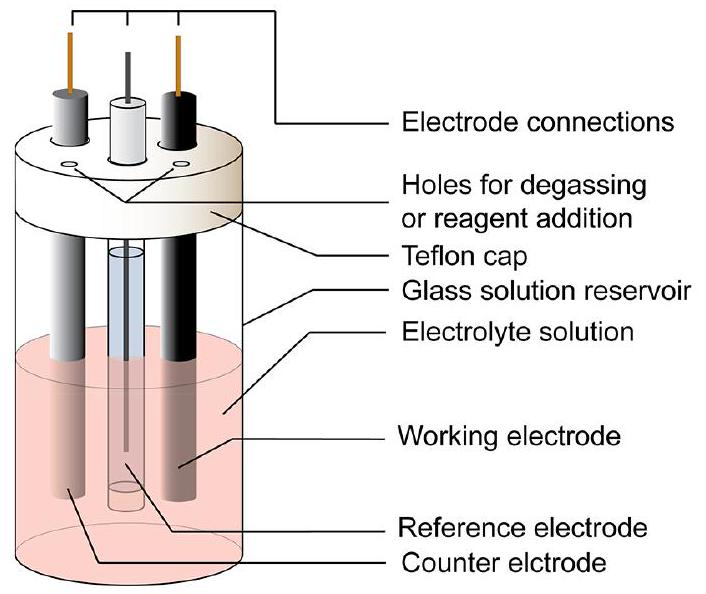
图4. 用于CV实验的电化学池示意图。
方框3. 电活性窗口有多宽?
电解质、溶剂和工作电极的性质都会影响CV实验可用的电位窗口。

3.1 电化学池简介
在描述电化学测量的论文的实验部分,通常会简要说明用于采集数据的实验装置。用于循环伏安实验的容器称为电化学池。电化学池的示意图见图4。接下来的部分将描述每个组件的作用,以及如何组装电化学池以在CV实验中采集数据。
3.2 电解质溶液的制备
在CV实验中发生电子转移时,通过溶液中离子的迁移来维持电中性。当电子从电极转移到分析物时,离子在溶液中移动以补偿电荷并闭合电路。一种称为支持电解质的盐溶解在溶剂中,以帮助降低溶液电阻。溶剂和支持电解质的混合物通常被称为“电解质溶液”。
溶剂。一种好的溶剂具有以下特点:
- 在实验温度下为液体。
- 能完全溶解分析物和高浓度的支持电解质。
- 在实验的电位范围内对氧化和还原稳定。
- 不会与分析物或支持电解质发生有害反应。
- 可以被纯化。
方框3中显示了一些用于无机电化学的常见溶剂的稳定电位窗口(“溶剂窗口”)。建议实验者严格确保溶剂不含杂质,必要时需严格无水。
支持电解质。一种好的支持电解质具有以下特点:
- 在所选溶剂中溶解度高。
- 在实验条件下化学和电化学性质惰性。
- 可以被纯化。
为了提高溶液电导率,需要高浓度的支持电解质。当电子转移在电极处发生时,支持电解质会迁移以平衡电荷并完成电路。溶液的电导率取决于溶解盐的浓度。如果没有电解质来达到电荷平衡,溶液将对电荷转移产生阻力(见下文如何最小化欧姆压降)。因此,高绝对电解质浓度是必要的。
为了限制分析物的迁移,也需要高浓度的支持电解质。分析物向电极表面的移动由三种传质模式控制:对流、迁移和扩散。通过对流移动的物质受到机械力的作用(例如,搅拌或振动)。在迁移中,离子溶质因电场作用而移动(例如,正离子被吸引到负电极)。扩散源于电化学池内两点之间的浓度梯度;这种浓度梯度导致分析物从高浓度区域移动到低浓度区域。所有的理论处理和模型都排除了分析物的迁移和对流。为确保这些传质机制最小化,通过不搅拌或振动来减少对流,并通过使用高浓度电解质来最小化迁移。 相对于分析物浓度,高电解质浓度确保了从统计学上讲,电解质更有可能迁移到电极表面以实现电荷平衡。
铵盐已成为在有机溶剂中进行无机电化学实验的首选电解质,因为它们满足了选择电解质的三个条件。对于二氯甲烷或乙腈溶液,通常使用四丁基铵()盐。对于苯等极性较小的溶剂,四己基铵盐的溶解度更高。虽然铵盐已成为标准的阳离子,但对阴离子的选择则不那么标准化,因为阴离子往往更容易与过渡金属分析物反应。最常用的阴离子是、、、和。阴离子的配位性越强,就越有可能与阳离子、溶剂或分析物发生不希望的相互作用。我们发现盐因其稳定性、非配位性、易于纯化和溶解度,是乙腈中理想的支持电解质。电解质的纯度至关重要,因为需要高浓度(我们常规使用的溶液),这意味着即使是最轻微的杂质也可能达到足以干扰测量的浓度。有关常见电解质盐纯化的信息,我们建议读者参阅参考文献1的第70页。
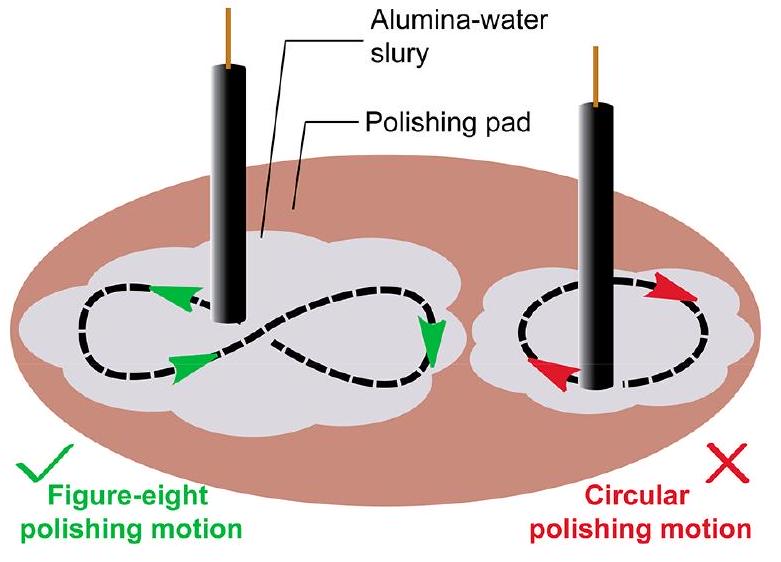
方框4. 如何抛光玻碳电极?
一种简单的抛光电极的方法是在铺有抛光布的垫上,用氧化铝水浆以“8”字形轨迹进行抛光。如果使用圆形轨迹,抛光通常不均匀,表面可能会变得倾斜。
方框5. 当数据报道为相对于“电极”时,这意味着什么?
正如我们所见,这可以涵盖许多不同的电极,因为使用不同组成的参比电极(例如,盐的种类、浓度)导致报道的氧化还原电位实际上处于不同的标度上。
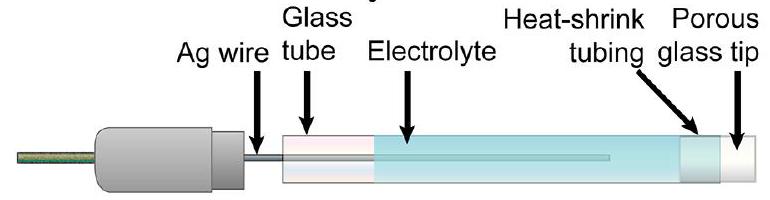
方框6. 如何组装一个简单的RE
组装一个基于银的参比电极的一种简单方法是将一根银丝穿入一个装有砂芯的小玻璃管中,然后用电解质溶液填充该管。
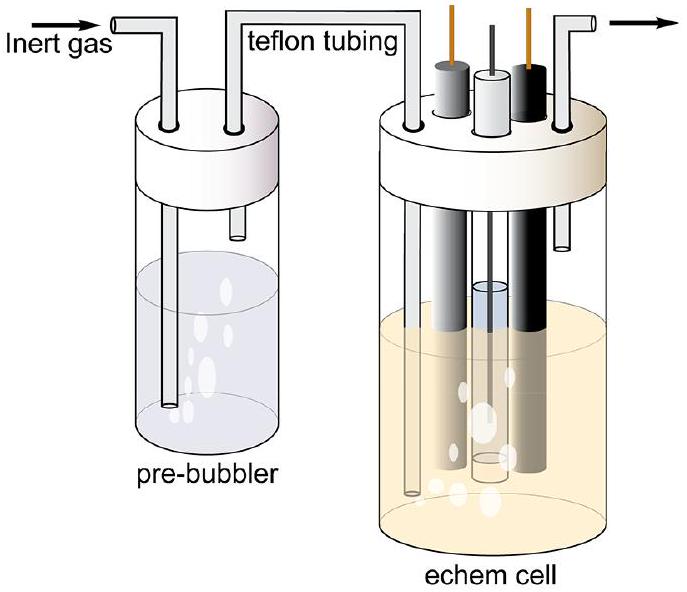
方框7. 如何在浓度变化最小的情况下对溶液进行吹扫除气
使用预饱和鼓泡器使惰性气体被溶剂蒸气饱和,有助于减少在吹扫过程中因蒸发而导致的电化学池中溶剂的损失。
3.3 选择电极并准备使用
图2的图注表明使用了三电极体系,包括一个玻碳工作电极、一个玻碳对电极和一个准参比电极。这种设置(图4)是包括循环伏安法在内的常见电化学实验的典型配置,这三个电极分别代表工作电极、对电极和参比电极。电流在工作电极和对电极之间流动,而参比电极则用于精确测量相对于一个稳定参比反应的外加电位。
工作电极(WE)。工作电极执行我们感兴趣的电化学事件。恒电位仪用于控制工作电极相对于参比电极电位的外加电位。工作电极最重要的方面是它由在感兴趣的电位范围内具有氧化还原惰性的材料组成。工作电极的类型可以根据实验的不同而变化,以提供不同的电位窗口或减少/促进目标物质的表面吸附(示例见方框3)。
因为我们感兴趣的电化学事件发生在工作电极表面,所以电极表面必须极其清洁且其表面积有明确的定义。抛光电极的程序因电极类型而异,并且可能因实验室而异。当使用玻碳或铂等电极时,可以通过机械抛光来制备清洁的电极表面(方框4)。为去除颗粒,然后将电极在超纯水中进行超声处理。 通常还需要在纯电解质中,在一个宽的电位窗口内进行几次CV扫描,以去除抛光过程中残留的任何吸附物质。这个过程可以重复进行,直到扫描重合且未观察到峰。这个程序有时被称为“预处理”电极。
对于玻碳电极,其表面一旦通过抛光被激活,反应性就非常高。当溶剂中存在杂质时,它们会优先吸附到电极的碳表面,导致伏安图发生改变。为了限制溶剂杂质的吸附,可以使用活性炭处理溶剂。
在测量前必须抛光电极,而且在实验过程中,常常需要在两次测量之间重新抛光电极,因为一些分析物容易在电极表面吸附。要确定分析物是否吸附在电极表面,可以进行一个简单的冲洗测试:记录伏安图后,冲洗工作电极,然后将其转移到仅含电解质的溶液中。如果通过CV未观察到电化学特征,这排除了强吸附(尽管不能排除弱吸附)。由于电极在实验过程中能够吸附物质,因此在每次实验后都对其进行抛光是一个好习惯。理想情况下,实验前后应使用不同的抛光垫以避免污染。
不同的电极材料也可能导致不同的电化学响应,例如当不同类型电极之间的电子转移动力学有显著差异时,当吸附只在某些电极材料上强烈发生时,或者当发生与底物有关的电极特异性反应时。因此,更换电极材料是诊断和评估这些问题的第一步。
参比电极(RE)。参比电极具有明确且稳定的平衡电位。它被用作一个参考点,在电化学池中可以据此测量其他电极的电位。因此,外加电位通常报道为“相对于”特定的参比。有几种常用的(通常是商业化的)电极组件,其电极电位与池中使用的电解质无关。在水性介质中常用的一些参比电极包括饱和甘汞电极(SCE)、标准氢电极(SHE)和电极。这些参比电极通常通过多孔砂芯与溶液隔开。最好通过使参比室中的溶剂和电解质与实验中使用的相匹配来最小化液接电位。
在非水溶剂中,通常使用基于电对的参比电极。这些电极由一根银丝和含有盐(通常是)的溶液组成。对于几种银盐、溶剂和浓度的组合,存在转换表,可以将用电极获得的数据参考到其他类型的参比电极。 参比电极的电位可能因、电解质或所用溶剂的变化而在不同实验间有所不同(见方框5),因此记录非水参比电极的具体细节非常重要。为规避这些问题,还原电位应相对于具有已知的内部参比化合物进行校准。二茂铁通常作为内标包含在所有测量中,并鼓励研究人员将报道的电位相对于二茂铁电对()进行校准。 应注意确保分析物的氧化还原过程的电位窗口不与二茂铁的重叠,并且分析物不与二茂铁相互作用。如果出现这种情况,可以使用许多其他具有明确氧化还原电对的内标(如十甲基二茂铁)。 由于非水参比电极的电位在实验过程中往往会漂移,我们建议在所有测量中都存在二茂铁,而不是在一组测量结束时才添加。
据报道,泄漏到分析物溶液的其余部分有时会成为一个问题, 这可能会干扰电化学测量。因此,必须非常小心以最小化这种可能性。一个选择是,结合使用内标,取消盐,改用一根在电解质中的银丝,通过砂芯与分析物隔开(见方框6)。这种银丝准参比电极大概是利用了银丝上天然的氧化层,使用由此产生的、不明确的电对。这种方法消除了银盐泄漏的可能性,但需要存在内标。
对电极(CE)。当向工作电极施加一个能使分析物发生还原(或氧化)的电位时,电流开始流动。对电极的目的是完成电路。电流被记录为电子在工作电极和对电极之间流动。为确保在对电极上发生的反应动力学不妨碍在工作电极上发生的反应动力学,对电极的表面积要大于工作电极的表面积。通常使用铂丝或铂片作为对电极,尽管也有碳基对电极可用。
当在工作电极研究还原反应时,对电极上发生氧化反应。因此,应选择尽可能惰性的对电极。根据实验的不同,对电极可能会产生副产物,因此,这些电极有时可能会通过一个带砂芯的隔室与系统的其余部分隔离。一个例子是,在工作电极研究THF中的还原过程时,对电极上可能发生THF的氧化聚合。
好的,这是您提供的文件中全部内容的完整、忠实、准确的中文翻译,并严格遵循了您要求的格式(物理化学名词加粗、行内公式用单美元符号 $包裹、行间公式用双美元符号 $$包裹、图片引用保持原样)。
3.4 数据采集步骤
记录背景扫描。
现在各组件都已准备好,可以组装电化学池并记录伏安图了。当电解质溶液中没有添加电活性物质时,伏安图应呈现出图2中蓝色曲线的轮廓。电极之间仍有微小电流流过,但没有观察到明显的特征。这种背景电流有时被称为电容电流、双电层电流或非法拉第电流。电流强度与所使用的扫描速率成线性关系(见下文)。背景扫描对于在加入分析物前测试电化学池的所有组件是否状况良好,以及量化电容电流至关重要。
惰性气氛的重要性。
一旦电解质溶液配制好,电化学池组装完毕,就可以开始实验了。考虑在通风橱中配制的乙腈溶液。从方框3可知,这种乙腈溶液的电位窗口很宽。如果在此窗口内扫描电位,应观察不到氧化还原事件(即,电流响应应相对平坦)。然而,如果使用上述方法制备的溶液进行此实验,当电位向阴极方向扫描时,会看到一个意想不到的峰(图2,红色曲线)。在反向扫描中,出现了另一个似乎与第一个峰相关的峰。为什么在没有分析物的情况下会观察到这些峰?答案在于溶液是在开放大气中制备的。虽然氮气在此窗口内是电化学惰性的,但氧气不是。氧气经历一次可逆的单电子****还原,形成氧自由基阴离子(超氧根,)。图2红色曲线中的峰归因于氧气的还原以及随后的再氧化。请注意,在乙腈以外的溶剂中,氧气的还原可能不是完全可逆的。
在电化学实验中,氧气的存在也会改变分析物的电化学响应。例如,在惰性气氛下,经历两次可逆的单电子****还原(图2,绿色曲线)。 然而,如果引入氧气,可逆性就会丧失,因为被还原的分析物可以将一个电子转移给溶解的,通过这个化学步骤被氧化(图2,橙色曲线)。为避免溶解的干扰,所有电解质溶液在测量前都应用惰性气体进行吹扫除气(见方框7)。一旦所有从电化学池中除去,用于吹扫的特氟龙管应置于溶液表面上方,以继续冲洗顶部空间,同时不扰动池中的溶液。另一个选择是将电极电缆引入惰性气氛手套箱,并使用预先除氧的溶剂进行电化学实验。
测量开路电位。
当电化学池组装好并加入分析物后,电极上会产生一个电位。例如,当将加入电化学池时,电极的电位与溶液达到平衡(因此没有电流流动)。在没有电流流动时观察到的电位称为开路电位(OCP)。OCP可以提供有关本体溶液中物质的氧化还原状态以及当溶液包含混合物时不同物质浓度的信息(实验模块1:二茂铁/二茂铁阳离子溶液的OCP测量:随溶液组成的变化)。
最小化欧姆压降。
到目前为止,我们考虑的电化学池都被假定是理想的。然而,电解质溶液在电化学池中具有固有的电阻(图5)。虽然一些恒电位仪可以补偿大部分这种溶液电阻(),但在工作电极(WE)和参比电极(RE)之间仍存在一部分未补偿电阻()(技术上讲,是在WE和穿过RE尖端的整个等势面之间,如参考文献24和25中所解释)。在电化学测量过程中,由于的存在,仪器记录的电位可能不是溶液中分析物所经历的电位。这种现象称为欧姆压降。CV中欧姆压降的一个明显迹象是,对于已知是电化学可逆的氧化还原事件,其伏安图中的峰峰分离增大(实验模块3:二茂铁的循环伏安法:电解质浓度对峰峰分离的影响作为溶液电阻的指示)。根据欧姆定律,由欧姆压降引起的电位差等于通过的电流()乘以电阻。对于较大的或值,由此产生的欧姆压降可能大到无法接受,并影响数据的准确性。
欧姆压降可以通过三种方法来减轻:(1)减小,通过减小工作电极的尺寸或将实验限制在慢扫描速率下;(2)降低,从而降低,通过增加电解质浓度来提高溶液的电导率;以及(3)直接减小(并增加),通过减小参比电极和工作电极之间的距离(见图5)。
对于大多数实验,这些方法将足以将欧姆压降减小到其总体影响可忽略不计的程度。然而,有时实验条件限制了这些方法的使用。为了解决这个问题,许多恒电位仪都配备了软件,可以实验性地确定并进行实时补偿(实验模块2:未补偿电阻的实验测定)。
 图5. 电化学池作为恒电位仪的表示。改编自参考文献1。版权所有 © 2006,经Elsevier许可。增加溶液的电导率会减小,从而减小。减小WE和RE之间的距离会减小。通常由恒电位仪补偿。
图5. 电化学池作为恒电位仪的表示。改编自参考文献1。版权所有 © 2006,经Elsevier许可。增加溶液的电导率会减小,从而减小。减小WE和RE之间的距离会减小。通常由恒电位仪补偿。
3.5 记录循环伏安图
一旦电化学池组装完毕、除氧完成,并已采取措施最小化欧姆压降,就可以进行实验了。将电极连接到恒电位仪,并通过恒电位仪软件选择实验参数。虽然不同的软件需要不同的参数,但基本的参数包括将要扫描的电位窗口(由初始、转换和最终电位定义)、扫描速率以及段数/扫描次数。一些恒电位仪允许从OCP开始扫描,此时溶液处于平衡状态,没有净电流通过。高级参数包括自动或手动补偿,并且通常特定于每个制造商的仪器。
4 超越简单的单电子可逆伏安图:不可逆性、耦合化学反应和多电子过程
有几种过程可以产生比简单、可逆、单电子转移反应数据更复杂的伏安图。在最简单的情况下,伏安图因慢电子转移或多电子转移而改变,循环伏安法可以为这些纯电子转移反应提供有用的信息。此外,当电子转移与化学反应耦合时,循环伏安法可以提供动力学和机理信息。在许多情况下,这些耦合反应可以与先前描述过的特定类型的机理相关联;因此,仔细检查伏安图可以帮助诊断正在发生哪种均相反应机理以及这些反应的动力学。 用于描述各种耦合反应情况的符号值得简要说明:E表示电子转移步骤,C表示均相化学反应(一个化学步骤)。此外,下标r表示可逆性,下标i表示不可逆性。每种反应都是针对分析物Ox还原为Red来描述的。同样的概念可以很容易地推广到氧化反应。
4.1 电化学不可逆性
当电极表面的电子转移相对于传质较慢时,该过程被称为“电化学不可逆”。如上文循环伏安图轮廓部分所述,慢的电极动力学需要明显更负的外加电位才能有可观的电流流过。结果是,峰峰分离大于电化学可逆单电子****氧化还原电对预期的(实验模块5:氧气的循环伏安法:评估电化学可逆性)。
4.2 两个连续的电子转移可逆过程
许多配合物可以经历多个可逆的氧化还原过程。 为简单起见,我们只考虑两个电化学步骤。伏安图的外观取决于两个电化学步骤的形式电位之差。如果第二个电化学步骤在热力学上比第一个更有利, 伏安图看起来与能斯特双电子转移完全相同,峰峰分离()将为,而不是单电子过程预测的。随着第二个电子转移在热力学上变得越来越不利,会增大,直到达到略高于的最大值;此时,波会分离成两个可分辨的波,每个波的(图6)。有关无机配合物伏安图中双电子波的实验示例,请参见参考文献28。
4.3 EC耦合反应 :可逆电子转移后跟不可逆均相化学反应
一个简单的例子是还原后跟一个不可逆化学反应,即机理
一个缓慢的均相化学反应(与电子转移相比)会导致一个看起来可逆的伏安图,因为反应生成Z的Red量可以忽略不计(图6)。 随着均相反应的速率常数()增加,化学反应中消耗的Red量增加,从而使系统偏离平衡,导致非能斯特响应。阳极与阴极峰电流之比减小,因为被还原的物质Red被后续的化学反应消耗掉了,导致在阳极扫描中可被氧化的物质减少。实验上,可以通过改变扫描速率来改变响应。当扫描速率增加时,实验的时间尺度与化学步骤的时间尺度相竞争,更多的Red被留下来进行再氧化。对于足够快的扫描速率,电化学特征将恢复可逆性,因为氧化反应胜过了化学反应。已经推导出从这些伏安图中提取动力学参数的方程。 关于从无机配合物与酸源反应的机理的伏安图中提取动力学信息的实验示例,请参见参考文献23。关于使用此方法估算还原/氧化后分子内分解速率的讨论,请参见参考文献29。
 图6. 使用DigiElch模拟软件为三种常见机理建模的伏安图示例。电流已归一化。机理:增加扫描速率(从(红色)到(绿色)再到(蓝色))可恢复可逆性(步骤的速率常数)。机理:步骤的正向速率常数越快,伏安图越可逆((蓝色),10(深绿色),100(浅绿色),(红色))。机理:随着两个还原电位()之间的分离减小,峰合并成一个单一的双电子峰。(深蓝色),0(浅蓝色),0.05(深绿色),0.1(浅绿色),0.15(橙色)和(红色)。
图6. 使用DigiElch模拟软件为三种常见机理建模的伏安图示例。电流已归一化。机理:增加扫描速率(从(红色)到(绿色)再到(蓝色))可恢复可逆性(步骤的速率常数)。机理:步骤的正向速率常数越快,伏安图越可逆((蓝色),10(深绿色),100(浅绿色),(红色))。机理:随着两个还原电位()之间的分离减小,峰合并成一个单一的双电子峰。(深蓝色),0(浅蓝色),0.05(深绿色),0.1(浅绿色),0.15(橙色)和(红色)。
4.4 CE耦合反应 :可逆化学步骤后跟可逆电子转移
另一个简单的例子是机理
在这个例子中,可用于还原的Ox的量由第一步的平衡常数决定。平衡常数越大,伏安图越可逆(图6)。在平衡常数大到可以被认为是不可逆反应的极端情况下,伏安图变得完全可逆。在某些情况下,可以从伏安图中提取平衡常数。
5 结论
定量电化学分析是探索支撑可再生能源技术和基础机理无机化学的电子转移反应的有力工具。越来越多的新兴研究者有兴趣利用电化学来推进他们的研究。通过本教程,我们的目标是为这些研究者提供一个易于理解和全面的指南,以便在研究和教育工作中使用循环伏安法。通过将电化学分析的理论基础与实际的实验细节相结合,强调实验中的陷阱,并提供入门培训模块,本文反映了当前学习和使用循环伏安法的最佳实践。